Die verschiedenen Phasen von klinischen Studien
Klinische Studien werden in mehreren Phasen durchgeführt. Jede Phase ist darauf ausgelegt, bestimmte Fragen zu beantworten; begleitend werden alle notwendigen Maßnahmen ergriffen, um für die Sicherheit der Teilnehmer:innen zu sorgen.
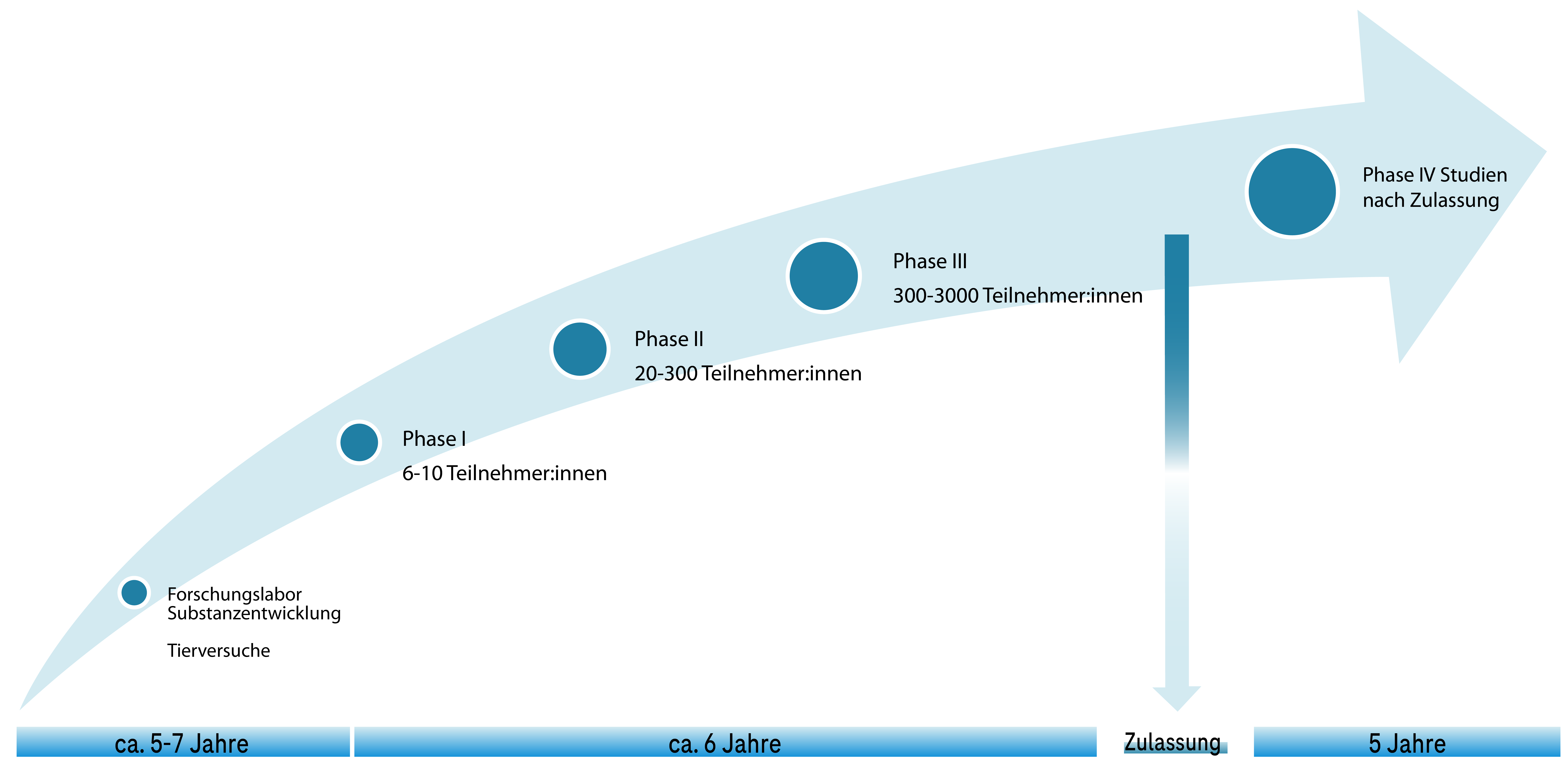
In der Regel wird jede neue Therapie in drei Phasen klinischer Studien geprüft, bevor die Aufsichtsbehörden sie als sicher und wirksam einstufen.
Die Phase-I-Studie: Überprüfung von Sicherheit und Verträglichkeit
Bei einer Phase-I-Studie gibt es nur wenige Teilnehmer:innen, typischerweise sechs bis zehn gesunde Freiwillige. Je nach Medikament können es aber auch schwerkranke Patient:innen sein, zum Beispiel in der Krebsforschung.
Studien der Phase I sind darauf ausgelegt, dass Forscher:innen und Ärzt:innen herausfinden, welche Auswirkungen das untersuchte Prüfpräparat bei Menschen hat. Hier geht es darum, im Hinblick auf die Sicherheit und Verträglichkeit zu untersuchen, was mit dem Arzneimittel im Körper passiert, nachdem es eingenommen bzw. als Spritze oder Infusion verabreicht wurde. Alle Studienteilnehmer:innen werden auf das Auftreten und den Schweregrad von Nebenwirkungen beobachtet, die eventuell bei ihnen auftreten können.
Die Phase-II-Studie: Überprüfung von Sicherheit und Wirksamkeit
Steht nach der Phase-I-Studie die Sicherheit des Prüfpräparates fest, wird in einer Phase-II-Studie eine größere Studienteilnehmer:innengruppe untersucht. Die Gruppe umfasst typischerweise 20 bis 300 Studienteilnehmer:innen, je nach Art und Häufigkeit der Erkrankung.
Studien der Phase-II dienen dazu, erste Bewertungen der Sicherheit und Wirksamkeit eines Prüfpräparates bei Studienteilnehmer:innen vorzunehmen, und werden oft eingesetzt, um festzustellen, ob unterschiedliche Dosierungen der Behandlung unterschiedliche Wirkungen hervorrufen.
Die Studienteilnehmer:innen werden mit dem Arzneimittel in unterschiedlicher Dosierung behandelt und eng überwacht, um die Wirkungen zu vergleichen und die sicherste und wirksamste Dosierung zu ermitteln. Oft werden mehrere Phase-II-Studien durchgeführt, um das Prüfpräparat bei verschiedenen Studienteilnehmer:innengruppen und in verschiedenen Anwendungsgebieten zu testen.
Die Phase-III-Studie: Bestätigung von Sicherheit und Wirksamkeit
In Studien der Phase III wird die Sicherheit und Wirksamkeit des untersuchten Arzneimittels bestätigt. Diese Studien werden meist mit sehr vielen Studienteilnehmer:innen durchgeführt, um den Nutzen und die Sicherheit der Therapie umfassend abzusichern. Die Studien der ersten drei Phasen können einen oder mehrere so genannte Behandlungsarme haben, in denen die Sicherheit und Wirksamkeit des untersuchten Prüfpräparates mit anderen verfügbaren Therapien verglichen wird oder das Arzneimittel in Kombination mit anderen Therapien untersucht wird. Auf der Grundlage der Phase-III-Studien wird entschieden, wie das Arzneimittel in Zukunft am besten bei Studienteilnehmer:innen anzuwenden ist.
Die Phase-IV-Studie: Studie nach Zulassung
Studien der Phase IV werden durchgeführt, nachdem das Arzneimittel von der Aufsichtsbehörde die Marktzulassung erhalten hat, also von Behandler:innen eingesetzt werden kann. Das Ziel ist es, weitergehende Informationen zur Wirksamkeit und Sicherheit des neuen Arzneimittels bei großen Studienteilnehmer:innenzahlen und bestimmten Untergruppen von Studienteilnehmer:innen sowie im Vergleich zu und/oder in Kombination mit anderen verfügbaren Therapien zu gewinnen. Diese Studien dienen dazu, die Langzeitwirkung des Arzneimittels zu beurteilen. Auch ermöglichen sie es, seltener auftretende Nebenwirkungen zu erkennen.
M-AT-00003107





